La tecnología CRISPR nos sigue sorprendiendo. Recientemente, un grupo internacional de investigadores ha logrado editar el genoma de embriones humanos con una muy alta eficiencia. En este trabajo el grupo corrigió una mutación autosómica dominante del gen MYBPC3 que causa una hipertrofia cardiaca, o sea que vuelve más grueso al corazón. Es importante notar, que al ser dominante es necesario solo reparar una de las copias del gen para el caso de los heterocigotos, lo cual lo vuelve mucho más sencillo.
El sistema de edición génica consta de tres componentes: un ARN guía, la enzima Cas9 y un ADN homólogo al gen que incluye los cambios que se quiere realizar (ssODN).
El método funciona de la siguiente manera: el ARN guía dirige a la enzima Cas9 a la región del genoma que se desea reescribir, una vez posicionada ahí, la enzima realiza un corte en las dos hebras de ADN. Esto genera una señal de peligro para la célula, lo que la obliga a resolver el problema y para ello una de las opciones que tiene es recombinar con una región homóloga de ADN, el ssODN, introduciendo los cambios que se desea realizar.
Para los que no conozcan la tecnología les recomiendo leer el artículo de Ciencia del Sur donde se describe esta tecnología más profundamente.
La edición del genoma humano no es algo nuevo, ya en el abril del 2015 un grupo de investigadores en China había logrado editar el gen de β-globina y diferentes grupos en Inglaterra y Suecia han trabajado en el tema, sin embargo los ensayos realizados presentaban una muy baja eficiencia y tenían varios problemas de modificaciones no deseadas.
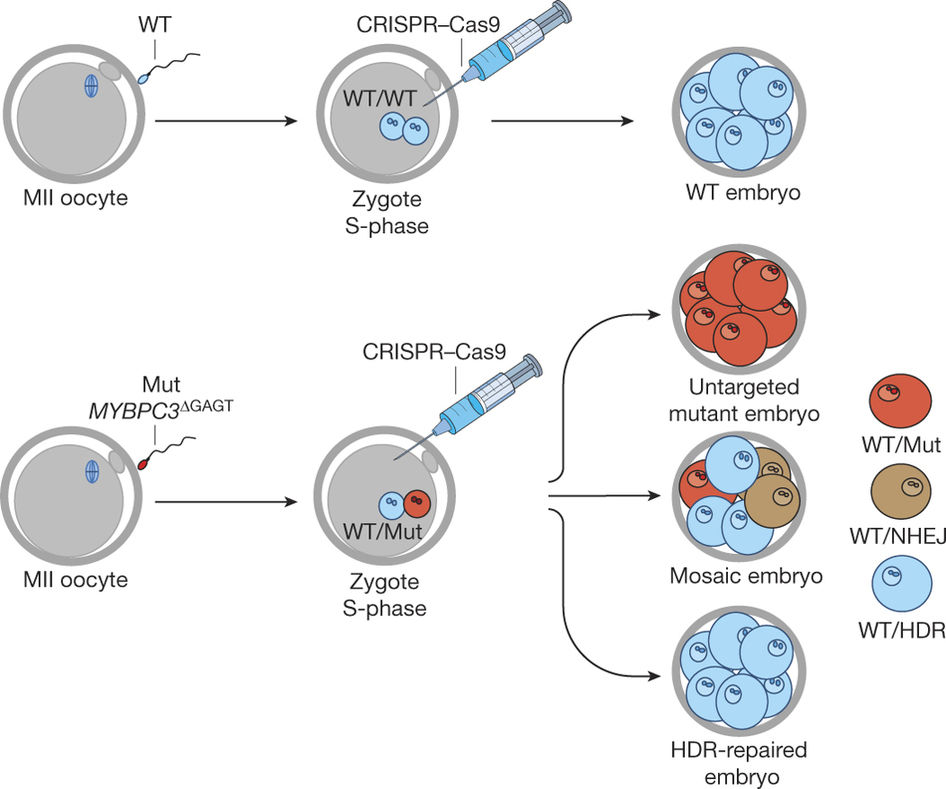
Mutaciones no deseadas y embriones mosaicos
Uno de los principales problemas de esta tecnología es la aparición de mutaciones en sitios no deseados (off target mutations), esto ocurre fundamentalmente porque el sistema se equivoca y realiza los cortes en lugares diferentes al blanco. Otro problema es la aparición de embriones mosaicos, donde dentro de un mismo embrión se encuentra una mezcla de células modificadas con células no modificadas. Hasta ahora, estas situaciones habían enlentecido el uso de esta tecnología.
Normalmente, lo que hasta este momento se hacía para editar el genoma humano era expresar los componentes del sistema. Para ello, se introduce el gen de Cas9 y el ARN guía de tal forma a lograr una expresión sostenida del sistema por un periodo de tiempo y así introducir las mutaciones deseadas.
El grupo liderado por el Dr. Mitalipov, supuso que al expresar la enzima Cas9 se encontraban activa por mucho tiempo lo que le llevaba a cometer errores. Por ello, decidieron microinyectar el ARN guía acoplado a la enzima, esto les permitió no tener mutaciones no deseadas. Además, a fin de evitar la presencia de embriones mosaico, el equipo introdujo todos los componentes del sistema al óvulo al mismo tiempo que lo ponía en contacto con el espermatozoide, esto le permitió que todas las células se encuentren modificadas.
Utilizando esta estrategia fueron capaces de modificar exitosamente 43 embriones de un total de 58 y obtener uno solo que fuera mosaico.
Ninguno de los embriones fue implantado, sin embargo esta publicación abre definitivamente las puertas a la edición genética en humanos e inicia fuertemente el debate de donde están los límites para esta tecnología. Nos hace pensar como sociedad hasta dónde vamos a permitir editar el genoma humano, y por otro lado si estamos en posición de poder controlarlo.
Es importante notar que este trabajo fue financiado por donantes privados, no se utilizaron fondos federales de Estados Unidos ya que este gobierno no autoriza el financiamiento para el estudio en embriones humanos. El debate ético se los dejo para los comentarios.
¿Qué te pareció este artículo?
Columnista de microbiología y biotecnología de Ciencia del Sur. Bioquímico egresado de la Facultad de Ciencias Químicas (FCQ) de la Universidad Nacional de Asunción (UNA), doctor en Ciencias mención en Microbiología egresado de la Facultad de Ciencias de la Universidad de Chile y exbecario DAAD. Profesor asistente y jefe del Departamento de Biotecnología de la FCQ-UNA. Sus líneas de investigación se centran en el uso de bacteriófagos (virus bacterianos) para el desarrollo de productos biotecnológicos mediante ingeniería genética y en la identificación de nuevos antivirales. Es investigador categorizado pol el PRONII del Conacyt.








 (21 votos, promedio: 4,33 de 5)
(21 votos, promedio: 4,33 de 5)







No veo ninguna razón que no sea egoísta para que prohíban esto