
Como cada año en la primera semana de octubre, los teléfonos de pocos investigadores afortunados recibieron una llamada de la Real Academia de Ciencias sueca.
Este año 2023, el Nobel en Medicina y Fisiología ha recaído en Katalin Karikó y Drew Weissman “por sus descubrimientos concernientes a modificaciones de bases nucleotídicas que posibilitaron el desarrollo de vacunas efectivas contra la COVID-19”. Un premio que se veía venir, pues las vacunas de ácido ribonucleico (ARN) fueron protagonistas de la lucha contra el virus.
Las vacunas de ARNm
Las vacunas ayudan a generar una memoria inmune del cuerpo en respuesta a un patógeno en particular.
Las vacunas “tradicionales” pueden ser de virus inactivados o debilitados, de vectores virales o incluso de proteínas recombinantes. En el caso de virus debilitados (e.g., la vacuna contra la poliomelitis) o de proteínas recombinantes (e.g., vacuna contra la hepatitis B), el agente inyectado estimula una respuesta inmune de manera directa.
En el caso de los vectores virales, partes del código genético de un agente patógeno son puestos en un virus inofensivo (vector), que una vez en el cuerpo, las proteínas codificadas por el vector son producidas por nuestras células, estimulando la respuesta inmune.
Para la industria farmacéutica, la producción de este tipo de vacunas es costosa, ya que requiere el uso de grandes volúmenes de cultivos y reactores de gran capacidad.
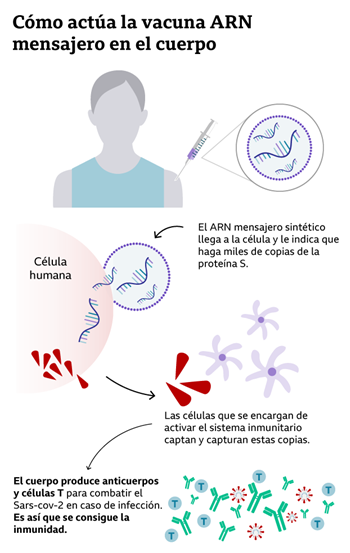
En el caso de las vacunas de ARNm (ARN mensajero), no son necesarios cultivos celulares, abaratando los costos y a la vez reduciendo los tiempos de producción. Un ejemplo directo de esto lo hemos tenido durante la pandemia de COVID-19, donde debutaron este tipo de vacunas. Las vacunas de ADN, que también surgieron durante la pandemia, se basan en un principio similar.
En nuestro cuerpo, todas las células nucleadas contienen el ADN, el cual constituye un “libro de instrucciones” para crear proteínas. Pero antes de ello, el ADN se transcribe a ARN mensajero (ARNm) y es el ARNm el que se traduce a proteína finalmente. El ADN contiene muchos otros elementos interesantes, y existen a su vez diversos tipos de ARN con diversas funciones, pero para el artículo de hoy nos enfocamos en el ARNm.
Al ingresar el ARNm en nuestras células, estas producen la proteína codificada por este. Las proteínas producidas son detectadas como foráneas por el cuerpo y el sistema inmune se activa. Se producen anticuerpos y linfocitos T de memoria. Cuando el cuerpo esté en contacto con el virus real, los anticuerpos ya existentes, junto con las células T, ayudarán a combatirlo, evitando que la enfermedad se desarrolle.
Recién en la década de los 90 se crearon métodos para producir ARN sin necesidad de cultivos celulares (transcripción in vitro). Se abrieron puertas en varios campos de investigación, incluidos el uso clínico del ARNm.
El difícil camino en la academia y una colaboración que cambiaría la historia
Muchas personas en internet están hablando acerca de la perseverancia de Karikó, la científica detrás de las vacunas de ARN, y ahora, con un Nobel bajo el brazo.
Esta científica de origen húngaro (nació en 17 de enero de 1955 en Szolnok) proviene de una familia humilde. Se graduó en biología en la Universidad de Szeged en 1978 y en 1982 obtuvo su doctorado en bioquímica en la misma casa de estudios. Trabajó luego como investigadora posdoctoral hasta que en 1985 emigró a Estados Unidos junto a su esposo e hija de 2 años. Su primer artículo científico fue publicado ese año y trata sobre el uso de liposomas para introducir ADN en células de mamíferos.
En EE.UU. trabajó en la University of Temple en Filadelfia y luego en la Uniformed Services University of the Health Sciences en Maryland como investigadora posdoctoral. En 1989 se convirtió en profesora asistente de investigación en la Universidad de Pensilvania, en Filadelfia (UPenn por sus siglas en inglés), cargo que perdería en 1995 tras no obtener fondos para sus investigaciones por varios años, y luego de que el profesor para el que trabajaba, Dr. Elliot Barnathan, dejara la universidad para ir a una empresa privada.
Durante sus años como profesora asistente, Karikó demostró que el ARNm puede ser introducido en células y estas son capaces de producir las proteínas codificadas en él. En los años 90, otros investigadores demostraron el uso de ADN/ARN para expresar genes foráneos en ratones.
Tras ser removida de su puesto como profesora asistente, aceptó un cargo menor como investigadora posdoctoral en otro departamento de la misma universidad (UPenn), bajo el mando del Dr. David Langer. Cuando este se retiró, de nuevo Karikó se quedó sin laboratorio y fondos para continuar su trabajo.
Drew Weissman, un inmunólogo estadounidense, empezó a trabajar en la UPenn en 1997, luego de trabajar con Anthony Fauci por varios años en el National Institutes of Health. Fauci es otra cara familiar que empezaríamos a ver bastante en la televisión a partir del 2020.
Cuenta la historia que Weissman y Karikó se “encontraron” al usar una fotocopiadora de la UPenn, donde empezaron a hablar e intercambiar ideas. Con la expertise de Weissman en células dendríticas y respuesta inmune, y el entusiasmo de Karikó en terapias que usasen ARNm, ambos decidieron colaborar para intentar hacer una vacuna contra el HIV.
Aunque Karikó podía inyectar ARNm a cultivos celulares y hacer que estos produzcan las proteínas deseadas, cuando el ARNm era introducido en ratones, los animales se enfermaban. Junto con Weissman, quien también comparte el premio Nobel de este año, observaron que el ARNm era reconocido como foráneo por las células, causando una respuesta inflamatoria no deseada.
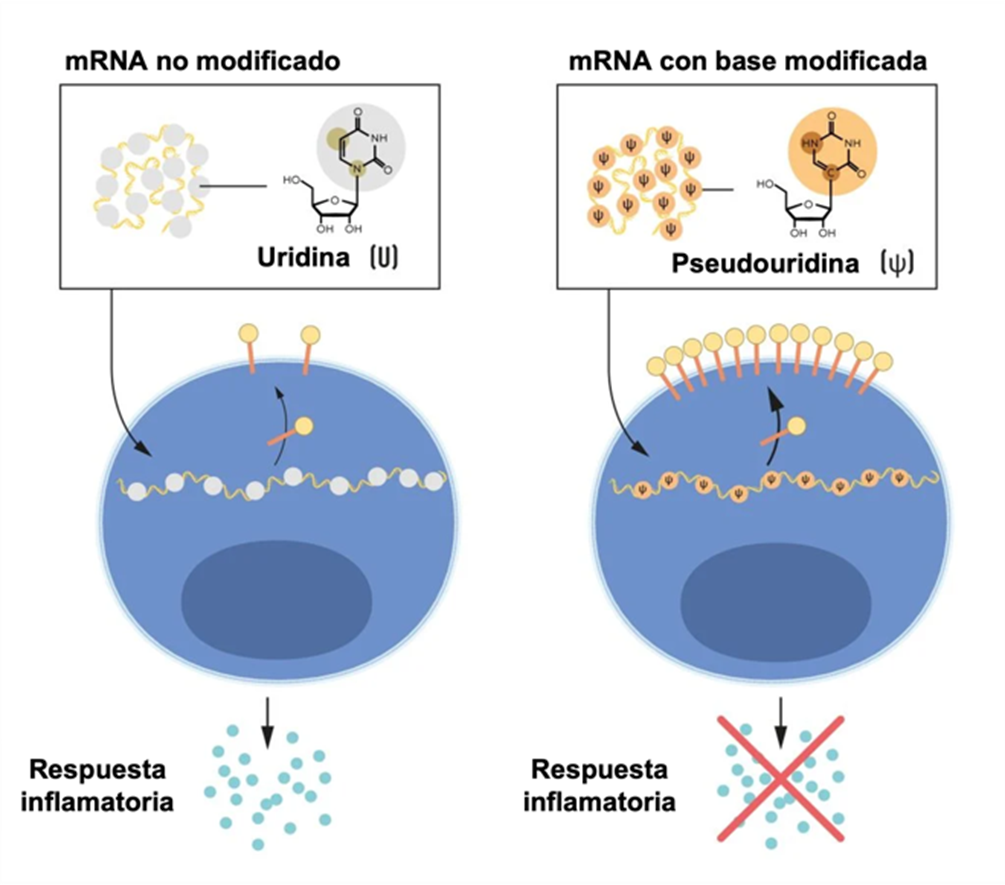
Karikó y Weissman notaron que la diferencias entre el ARNm hecho en las células y el in vitro era la presencia de modificaciones químicas postranscripcionales. Para probar la hipótesis de que esto era la causa de la respuesta inflamatoria, cambiaron las distintas bases y probaron el ARNm en células dendríticas. Eureka! La respuesta inflamatoria desaparecía cuando las modificaciones en el ARNm eran incluidas.
En específico, la presencia de pseudouridina, una base común en el ARN transferente (ARNt), permitía evadir la respuesta inmune. Estos resultados se publicaron finalmente en 2005 (Karikó et al, 2005). En publicaciones posteriores (Karikó et al. 2008 y Anderson et al. 2010), demostraron que la modificación de bases, además, ayudaba a aumentar la producción de proteínas codificadas por ese ARNm.
A pesar de los buenos resultados, Weissman y Karikó tuvieron que luchar para conseguir fondos para continuar con sus investigaciones, ya que nadie parecía estar interesado en la tecnología. Moderna (EEUU) y BioNTech (Alemania) fueron los primeros en empezar a apostar por ellos, y BioNTech en alianza con Pfizer empezaron a apoyar financieramente al laboratorio de Weissman. Karikó y Weissman fundaron su propia compañía biotecnológica (RNARx), sin éxito. Finalmente, la UPenn, dueña de las patentes por los descubrimientos de ambos, cedió las patentes a Cellscript.
En 2013, Karikó dejó la UPenn para trabajar en una pequeña compañía que “ni siquiera tenía página web”, BioNTech. Karikó es vicepresidenta senior de BioNTech desde 2019.
En 2015, junto con Weissman y otros colaboradores, publicaron un paper donde utilizaban nanopartículas lipídicas para transportar el ARNm dentro de las células en ratones (Pardi, et al. 2015).
Varias compañías empezaron a explorar la tecnología del ARNm para producir vacunas contra el virus del zika y el MERS-CoV. La rapidez con la que se pueden desarrollar vacunas de ARN fue vital en 2020, cuando en noviembre de ese año, apenas 8 meses después de declarada la pandemia, las vacunas desarrolladas por Pfizer/BioNTech y Moderna demostraron una protección del 95%. Tras la publicación de la secuencia del virus SARS-CoV-2, a BioNTech le tomó apenas horas diseñar la vacuna contra la COVID-19. A Moderna le tomó 2 días —todo gracias a que ambos ya contaban con la infraestructura para producir las vacunas.
Aunque Karikó retiene un puesto como profesora adjunta en la UPenn, ya no realiza investigaciones para la universidad desde hace muchos años. Varias fueron las críticas a la universidad por no haberla apoyado durante su carrera e incluso haberla bajado de categoría cuando fue removida como profesora asistente. También están en el blanco de las críticas los sistemas de fondos de investigación, que rechazaron una y otra vez los proyectos de Karikó sobre vacunas de ARNm. La Upenn no se ha disculpado y se ha reservado emitir comentarios hasta la fecha.
Sin los descubrimientos de Karikó y Weissman, el desarrollo de vacunas de ARNm y la rápida respuesta contra la COVID-19 no hubiera sido posible. También cabe destacar a BioNTech, una pequeña empresa alemana de inmigrantes turcos que apostó a la tecnología del ARNm.
Además de la vacuna contra el SARS-CoV-2, no existen vacunas de ARNm aprobadas hasta el momento. Sin embargo, las vacunas de ARNm se están investigando actualmente para combatir enfermedades como el zika, la gripe, la rabia, el citomegalovirus e incluso para enfermedades no infecciosas como el cáncer.
Un dato curioso: la hija de Karikó, Susan Francia, ganó 2 medallas de oro en remo para Estados Unidos durante los Juegos Olímpicos de Pekín 2008 y Londres 2012. La historia de Susan, Katalin, BioNTech y el propio Weissman (hijo de inmigrantes italianos) habla de la importancia del impacto que los migrantes pueden tener en países desarrollados, en un momento donde el mundo enfrenta varias crisis migratorias productos de conflictos y escasez de alimentos.
Referencias
- Costa, C.y Tombesi, C. (2020) Covid-19: los 3 pasos del revolucionario método ARNm usado para crear vacunas que muestran resultados eficaces contra el coronavirus: https://www.bbc.com/mundo/noticias-55091870
- Kolata, G. (2023) Long Overlooked, Kati Kariko Helped Shield the World From the Coronavirus: https://www.nytimes.com/2021/04/08/health/coronavirus-mrna-kariko.html
- Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
- Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
- Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
- Pardi, N., Tuyishime, S., Muramatsu, H., Karikó, K., Mui, BL., Tam, Y. K., Madden, T. D., Hope, M. J., Weissman, D. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes. J Control Release Nov 10;217:345-51. (2015)
¿Qué te pareció este artículo?
Columnista de ciencias biológicas, biotecnología, microbiología, educación y ciencia en Chile y Alemania.
Doctora en biotecnología molecular por la Universidad de Chile, exbecaria del programa "Don Carlos Antonio López". Bioquímica y bioquímica clínica egresada de la Universidad Nacional de Asunción, fue presidenta de Estudiantes de Bioquímica Asociados del Paraguay. Actualmente es investigadora Post doctoral de la Universidad de Freiburg (Alemania), trabajando con microorganismos extremófilos y desarrollo de herramientas de edición genética como CRISPR.














