
CRISPR fue la crónica de un premio anunciado. Por varios años, muchos de nosotros hemos esperado que esta innovación sea premiada y sin embargo nunca parecía el momento adecuado. Los más optimistas decían que el premio se daría en unos 5 o 10 años, ya que generalmente suele pasar bastante tiempo hasta que el comité Nobel decida laurear.
Además, mucho de lo que proponemos de CRISPR es potencial. Actualmente no existen todavía terapias aprobadas en humanos que involucren CRISPR y sin embargo, el miércoles hemos despertado con la noticia de que el Nobel de Química 2020 caía en manos de Emmanuelle Charpentier y Jennifer A. Doudna.
Por primera vez en la historia, un Nobel de ciencia era otorgado a un equipo formado solo por mujeres, pero a la vez, un sabor agridulce empapaba esta historia, ya que el español Francis Mojica había sido dejado fuera del podio. Al igual que varios otros actores claves, como Feng Zhang, del Broad Institute.
Pero ¿qué es CRISPR y por qué los científicos estamos tan fascinados por esta técnica? ¿Cuáles fueron los aportes de Mojica, Doudna y Charpentier?
Personalmente, ha sido la primera vez que he visto el desarrollo de una herramienta que promete revolucionar la ingeniería genética (y de hecho ya lo hizo) y que se logró alzar con el Nobel en tiempo récord. La tecnología CRISPR es tan prometedora que ocasionó una guerra de patentes entre el Broad Institute (MIT) y la Universidad de California en Berkeley que aún sigue en pie, por los derechos intelectuales del invento y por tanto su derecho de comercialización.

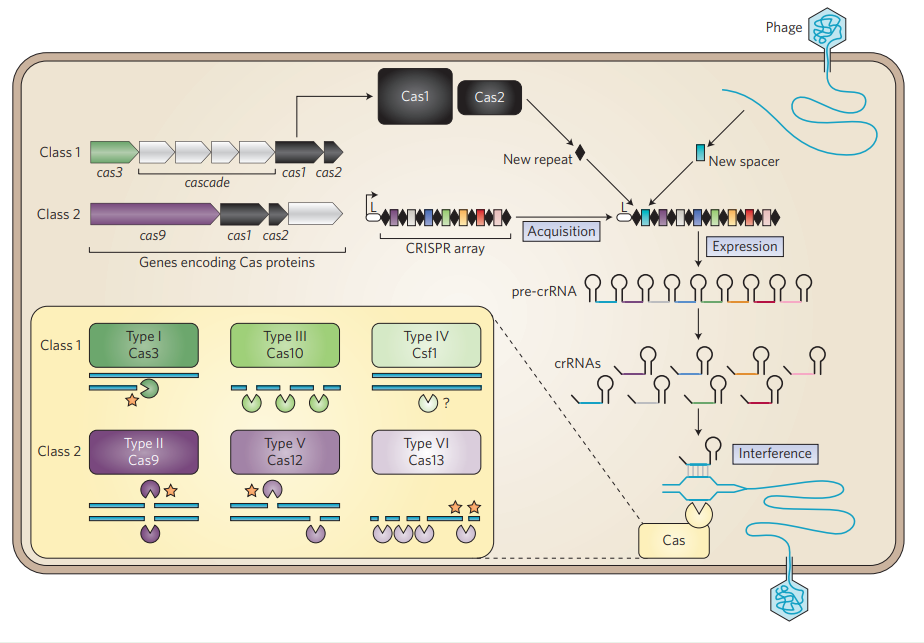
CRISPR son las siglas de Clustered Regularly Interspaced Short Palindromic Repeats o, en españñol, Secuencias Palindrómicas Cortas Repetidas Agrupadas y Regularmente Espaciadas.
Un CRISPR array en el genoma consiste en un grupo de secuencias de ADN llamados “espaciadores”, que corresponden a fragmentos de virus que han infectado anteriormente al microorganismo (bacteria o arquea). Estos espaciadores están separados por secuencias palindrómicas iguales (las secuencias palindrómicas son aquellas que se pueden leer de igual manera tanto en la hebra molde como en la hebra no molde, por ejemplo: AAATTT).
Además de estas secuencias, también encontramos genes de proteínas asociados a estos clústeres. Esas proteínas, las proteínas Cas (CRISPR Associated Sequences) participan en la adquisición de los espaciadores, la maduración de los ARN que derivan de los espaciadores y posteriormente otras proteínas Cas utilizan estos ARN como guías para atacar a virus que ingresan a la célula.
La gracia de CRISPR es que el uso de estos ARN (crARN) permite que las enzimas Cas corten el ADN invasor en lugares muy específicos, solo donde el crARN sea complementario a la hebra de ADN invasor.
La edición genética con CRISPR consiste en otorgar a la célula un espaciador que guíe a las enzimas Cas a cortar un lugar específico en el genoma, a la vez que se le da una secuencia “alternativa” con la cual puede realizar recombinación, para borrar de su genoma la secuencia objetivo del sistema CRISPR.
Así, las células que logran recombinar y cambiar su secuencia sobreviven, y las que no, mueren. Esta tecnología se puede usar para editar el genoma de todos los seres vivos, incluidos los humanos, para borrar mutaciones que dan lugar a enfermedades genéticas, como el cáncer.
El aporte de Mojica y de los otros
CRISPR tiene un origen muy humilde. En la década de los 80 ya se habían identificado secuencias cortas separadas por palíndromos repetidos, pero simplemente constituían una “curiosidad” en el genoma (Ishino, 1987). No se tenían pistas de su función. Estas secuencias se utilizaron entonces para tipificado de bacterias de la misma especie (M. tuberculosis y posteriormente S. pyogenes).
Por 1992-5, estas mismas secuencias se detectan en cianobacterias y en Haloferax (arqueas).

En la década del 2000, más genomas estuvieron disponibles gracias al advenimiento de las tecnologías de secuenciamiento masivo, en varias de estas se encontraron estos clústeres de palíndromos (Mojica, 2002).
La empresa de comida Danisco empezó a investigar estas secuencias, para poder utilizarlas en la diferenciación de bacterias del yogur, Streptococcus thermophilus. Asociaron estas secuencias con resistencia a fagos, descubrieron que estas secuencias se podían adquirir con el tiempo, pero los resultados no los publicaron hasta el 2007.
En el 2002, el español Francis Mojica acuña por primera vez el término CRISPR en una correspondencia con Ruud Jansen, y este usa esa palabra en un paper publicado ese año. El grupo de Mojica estudió el sistema CRISPR de una arquea llamada Haloferax mediterrani y fueron los primeros en proponer que se trataba de un “sistema inmune adaptativo” de las bacterias y arqueas en contra de los fagos, plásmidos y otras secuencias de ADN/ARN (Mojica, 2005).
En paralelo, el grupo de Pourcel publicaba resultados similares ese mismo año (Pourcel, 2005).
En el año 2007, finalmente, un grupo de científicos de Danisco publica sus resultados: es posible volver inmune a Streptococcus thermophilus al ataque de ciertos fagos alterando la secuencia de los espaciadores del CRISPR array (Barrangou, 2007), demostrando así la teoría del grupo de Mojica.
Las primeras ideas de la función de CRISPR fue que se trataba de un sistema similar al iARN (ARN de interferencia) de procariotas. En el 2008, el grupo de John van der Oost (Países Bajos) demuestra que las secuencias de espaciadores se transcriben a ARN cortos, llamados CRISPR ARNs o crARN, que guían a las proteínas Cas (Brouns, 2008).
En otra parte del mundo, exactamente en Illinois, Luciano Marraffini y sus colegas demuestran que CRISPR ataca ADN y no ARN, por tanto, es diferente al iARN (Marraffini, 2008). En el 2009, otro grupo demostraría que existe otro tipo de sistema CRISPR que ataca ARN (Hale, 2009).
En el 2011, un grupo de la Universidad de Vilna en Lituania demostraría que es posible expresar el sistema CRISPR de otra especie, S. thermophilus, en E. coli, otorgando inmunidad contra plásmidos. Más tarde se usaría este sistema para estudiar en detalle la proteína Cas9 y su modo de clivaje del ADN, se descubrirían las secuencias PAM por análisis bioinformático.
En el 2012, Emanuelle Charpentier y Jennifer Doudna publican un estudio demostrando que la proteína Cas9 de S. pyogenes es capaz de realizar cortes en la cadena doble hebra de ADN en sitios específicos, guiados por las secuencias de ARN generadas a partir del clúster de repetidores y espaciadores (Jenik, 2012).
Por esa misma época, el grupo del científico lituano Virginijus Šikšnys demuestra también que la proteína Cas9 puede ser guiada por secuencias de ARN en S. thermophilus (Gasiunas, 2012). Se empiezan a generar espaciadores para atacar secuencias que nosotros mismos programamos.
Pero lo más emocionante estaba por venir.
chemistry-2020-figure2-en
En enero de 2013, Feng Zhang, del Broad Institute del MIT y Hardvard logra adaptar CRISPR-Cas9 para la edición de genomas en células eucariotas de ratones y humanos (Cong, 2013). George Church y su grupo de Harvard publican resultados similares en el mismo número de la misma revista (Mali, 2013), al igual que Jin-Soo Kim de la Universidad de Corea del Sur (Cho, 2013)
Finalmente, en el año 2015 se logra trasladar la técnica a embriones humanos (Liang, 2015). El grupo de Junjiu Huang (China) logra editar el gen de la globina, pero con baja eficiencia, obteniendo muchos embriones mosaicos, es decir compuestos por células con la mutación y sin ella.
En el 2017, otro grupo, esta vez de Estados Unidos, logra corregir una mutación genética en embriones humanos, esta vez con alta eficiencia (más detalle en este artículo de Pablo Sotelo), curando así potencialmente una enfermedad hereditaria: la hipertrofia cardiaca.
Y de manera controversial, He Jiankui (China) anunció en noviembre de 2018 el nacimiento de unas niñas cuyos genomas habían sido editados con CRISPR-Cas cuando eran embriones mediante un video posteado en Youtube. El anuncio recibió una condena de la comunidad científica internacional y el investigador fue condenado a tres años de prisión.
Premio Nobel y perspectivas
El sistema CRISPR está revolucionando la ciencia. Hoy en día es difícil encontrar un laboratorio donde la técnica no se esté empleando, aunque sea como técnica auxiliar de biología molecular. En menos de una década, se han generados una variedad de organismos genéticamente modificados con CRISPR, porque la técnica es barata y sencilla en comparación a otras.
La misma Charpentier posee dos empresas avocadas a ingeniería con CRISPR/Cas9: ErsGenomics y CRISPR Therapeutics.
Sin embargo, la técnica aún necesita ser afinada para ser usada en humanos, ya que se han reportado cortes no específicos en el ADN, que podría llevar a mutaciones con consecuencias para los usuarios de esta terapia (Shaefer, 2017).
En setiembre de este año, un comité compuesto por científicos de Reino Unido y Estados Unidos concluyó que la tecnología CRISPR no está lista para ser usada en humanos (Ledford, 2020).
Pero CRISPR también plantea preguntas éticas respecto hasta qué tan lejos podemos jugar con el genoma y editarlo ¿Qué pasaría con esta herramienta en las manos equivocadas, donde no solo quieran evitar enfermedades, sino crear superhumanos o al menos humanos con los rasgos deseados?
En este paso que dimos por la historia de CRISPR espero que hayan podido reconocer a varios actores olvidados. Entre ellos, varios que no nombré, como los investigadores jóvenes y los investigadores posdoctorales que muchas veces son quienes hacen el trabajo de mesón.
En parte resulta polémico que los premios Nobel solo reconozcan el trabajo de estas dos mujeres -increíbles, sí, y sin duda un ejemplo para millones de niñas alrededor del mundo- pero que se basaron en el trabajo de otras personas.
¿Por qué el premio Nobel fue solo para ellas? porque ellas fueron quienes vieron el potencial de usar CRISPR para ingeniería genética, que es finalmente lo que se premió dejando en un mal plano a la ciencia básica.
Lo mismo pasó con el Premio Princesa de Asturias en el 2015, donde se reconoció a Charpentier y Doudna, dejando de lado al español Mojica, a Zhang y los demás.
Hoy más que nunca debemos entender que los descubrimientos se dan a pasos pequeños pero que debemos estar preparados cuando esos pasos nos alcanzan. La investigación se construye internacional y colaborativamente, y la historia de CRISPR es reflejo de ello. Muchas personas han quedado fuera del podio y cada vez es más evidente que la forma en la que se otorgan los premios Nobel necesita una revisión.
popular-chemistryprize2020
Bibliografía
Mas de la historia de CRISPR
-Barrangou, P & Horvath, P (2017) A decade of discovery: CRISPR functions and applications. Nature Microbiology (2).
-Broad Institute. Question and Answers about CRISPR.
-Cyranoski, D. (2018) CRISPR-baby scientist fails to satisfy critics. Nature
-Lander, E. S. (2016) The heroes of CRISPR. Cell (164)
-Ledford, H. (2016) The unsung heroes of CRISPR. Nature
-Ledford, H. (2020) ‘CRISPR babies’ are still too risky, says influential panel. Nature
Publicaciones claves
-Barrangou, R., Fremaux, C., Deveau, H., Richards, M., Boyaval, P., Moineau, S., Romero, D.A., and Horvath, P. (2007). CRISPR provides acquired resistance against viruses in prokaryotes. Science 315, 1709–1712. Demostración de la teoría de que CRISPR constituía un “sistema inmune adaptativo” contra el ataque de fagos.
-Cong, L., Ran, F.A., Cox, D., Lin, S., Barretto, R., Habib, N., Hsu, P.D., Wu, X., Jiang, W., Marraffini, L.A., et al. (2013). Multiplex genome engineering using CRISPR/Cas systems. Science 339, 819–823. Una de las primeras ediciones en células eucariotas.
-Charpentier, E. & Doudna, J. (2013) Rewriting a genome. Nature 495, 50–51.
-Cho, S., Kim, S., Kim, J. et al. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nat Biotechnol 31, 230–232 (2013). Una de las primeras ediciones en células eucariotas.
-Gasiunas, G., Barrangou, R., Horvath, P. & Siksnys V. (2012) Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci USA , 109:E2579–2586. Publicación independiente al grupo de Doudna y Charpentier donde se demuestra que la proteína Cas9 puede ser guiada.
-Hale, C.R., Zhao, P., Olson, S., Duff, M.O., Graveley, B.R., Wells, L., Terns, R.M., and Terns, M.P. (2009). RNA-Guided RNA Cleavage by a CRISPR RNA-Cas Protein Complex. Cell 139, 945–956. Primera publicación donde se describe un tipo de Sistema CRISPR que corta ARN.
-Ishino, Y., Shinagawa, H., Makino, k., Amemura, M. & Nakata, A. (1987) Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology, 169 (12) 5429-5433. Primera descripción del clúster de secuencias que luego se llamaría CRISPR.
-Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A. & Charpentier, E. (2012) A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science 337, 816-821. Demostración de que el Sistema CRISPR podía ser guiado.
-Mali, P., Yang, L., Esvelt, K.M., Aach, J., Guell, M., DiCarlo, J.E., Norville, J.E., and Church, G.M. (2013). RNA-guided human genome engineering via Cas9. Science 339, 823–826. Una de las primeras ediciones en células eucariotas.
-Marraffini, L.A., and Sontheimer, E.J. (2008). CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA. Science 322, 1843–1845. Paper que evidencia que CRISPR ataca ADN, posteriormente se conocería otro tipo de CRISPR que ataca ARN.
-Mojica, F.J.M., Diez-Villaseñor, C.S. & Soria, E. (2002) Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria. Mol Microbiol 1 (36) 244-246.
-Mojica, F.J.M., Diez-Villaseñor, C.S., Garcia-Martinez, J.S. & Soria, E. (2005). Intervening Sequences of Regularly Spaced Prokaryotic Repeats Derive from Foreign Genetic Elements. J Mol Evol 60, 174–182. Primeras teorías de la significancia biológica de CRISPR como sistema de defensa.
-Pourcel, C., Salvignol, G. & Vergnaud, G. (2005). CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA, and provide additional tools for evolutionary studies. Microbiology 151, 653–663. Primeras teorías de la significancia biológica de CRISPR como sistema de defensa.
-Schaefer, K., Wu, W., Colgan, D. F., Tsang S. H., Bassuk, A. G. & Mahajan, V. B. (2017) Unexpected mutations after CRISPR–Cas9 editing in vivo. Nat Methods 14, 547–548. Mutaciones inesperadas utilizando CRISPR in vivo
¿Qué te pareció este artículo?
Columnista de ciencias biológicas, biotecnología, microbiología, educación y ciencia en Chile y Alemania.
Doctora en biotecnología molecular por la Universidad de Chile, exbecaria del programa "Don Carlos Antonio López". Bioquímica y bioquímica clínica egresada de la Universidad Nacional de Asunción, fue presidenta de Estudiantes de Bioquímica Asociados del Paraguay. Actualmente es investigadora Post doctoral de la Universidad de Freiburg (Alemania), trabajando con microorganismos extremófilos y desarrollo de herramientas de edición genética como CRISPR.







 (7 votos, promedio: 4,43 de 5)
(7 votos, promedio: 4,43 de 5)







Estuve leyendo sobre el tema, en más de una revista especializada. Mojica, quien fue el que más aportó en este tema, tuvo la mala suerte de nacer varón.
De haber nacido mujer, le entregaban el premio sin mayores inconvenientes. Esto no es ya un premio a los científicos por su labor en el campo de la ciencia. Es un premio que responde a la dictadura de lo políticamente correcto.
«¿Qué pasaría con esta herramienta en las manos equivocadas, donde no solo quieran evitar enfermedades, sino crear superhumanos o al menos humanos con los rasgos deseados?»
¿Porqué crear superhumanos o humanos con rasgos deseados sería algo propio de «manos (o sea, personas humanas) equivocadas»?
No veo porqué el azar tenga que ser la entidad que lleve adelante la producción de un superhumano o humano con rasgos deseados. Después de todo, si fruto del azar surgiese un superhumano o humano con rasgos deseados, nadie cuestionaría ni condenaría este hecho.
Hola Roberto! Es una opinion personal. Creo que la evolucion nos ha llevado a adaptarnos como especie en el mundo y a sobrevivir. No me parece que exitan «rasgos humanos deseados», cuales son? ojos verdes, pelo rubio? el arqueotipo de belleza europeo yankee que nos vende Hollywood? A eso me refiero cuando hablo de rasgos. Por supuesto que podriamos curar todas las enfermedades y hacer del mundo un lugar mejor, pero esas no serian las «manos equivocadas»…
Puede surgir por «azar» una persona con ciertos rasgos pero no me parece que «bebes a la carta» sea una buena idea. Personalmente, valoro mucho la diversidad cultural y etnica.
No empecemos a hablar de quien podria tener acceso a esto y quien no, porque ahi el terreno es cada vez mas pantanoso.
Como te digo, es una opinion personal, aunque creo que muchos cientificos aun coinciden con esto, por eso (entre otras razones) es que no se aprueba el uso de esta y otras tecnicas en embriones a ser implantados.
Saludos